|
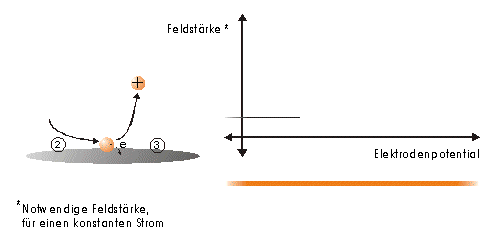
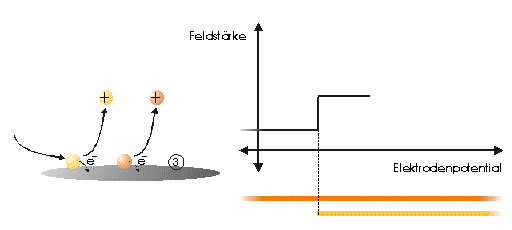
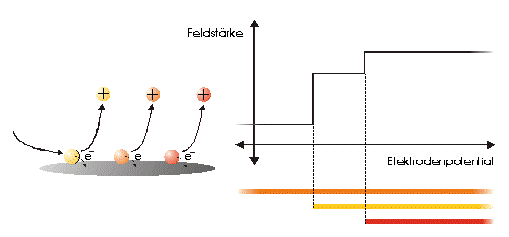
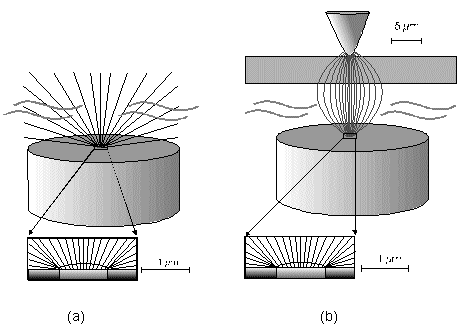
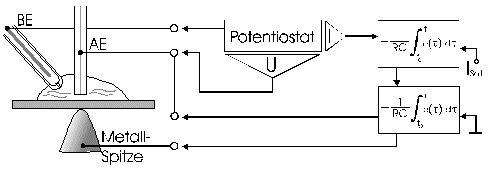
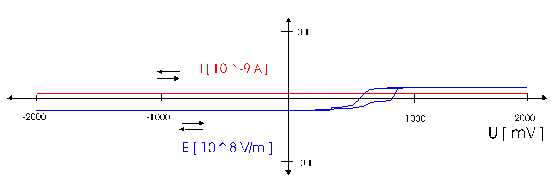
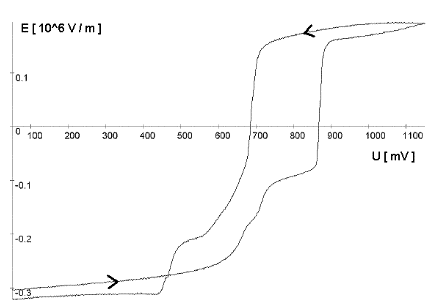
Strommanipulation an einer MikrodiskelektrodeDer Einfluß eines elektrischen Feldes auf die Migration von IonenElektrodenvorgänge bieten der Forschung seit ihrer Entdeckung einen komplexen Sachverhalt und geben ihr bis heute Rätsel auf. Es wurden und werden viele Versuche unternommen, in die vielen wechselwirkenden Prozesse einer Elektrodenreaktion Licht zu bringen. Diese Entwicklung zeigt, wie elektrochemische Vorgänge durch ein elektrisches Feld, das direkt einer Mikrodiskelektrode überlagert wird, gesteuert werden können. Ziel dieser hier dargestellten Entwicklung ist die Nutzbarmachung des Verfahrens für die Analytik. Der Strom an einer Elektrode lässt sich in zwei Bestandteile aufspalten [1,2]. Zum einen ist es der Übergang von Elektronen eines Reaktionspartners von oder zur Elektrodenoberfläche in Abhängigkeit vom vorgelegten Elektrodenpotential. Zum anderem übt genau dieses Elektrodenpotential auf Ionen eine Kraft aus, die wiederum die Transportgeschwindigkeit vorgibt und somit den Strom bestimmt. Wird das Elektrodenpotential geändert, ändert sich nicht nur die Anzahl der Reaktionspartner, die oxidiert bzw. reduziert werden, sondern auch der Kräfteeinfluß auf die Ionen. Neben der Anzahl, der für den Ladungstransport zur Verfügung stehenden Ionen, ist dieser Kräfteeinfluß hauptverantwortlich für die Stärke des Stromflusses. Die Ursache für beide Mechanismen ist eine elektrische Potentialdifferenz, eine Spannung. Um Redoxreaktionen, also Elektronenübergänge auszulösen, bedarf es zum Abtransport von Elektronen sowohl einer elektrischen Potentialdifferenz als auch eines geschlossenen Stromkreises. Um hingegen auf einen geladenen Körper Kraft auszuüben, genügt die Spannung eines nicht leitenden elektrischen Feldes. Darin unterscheiden sich diese gekoppelten Mechanismen, die bisher in Abhängigkeit vom Elektrodenpotential immer gemeinsam auftraten.Die entgegenwirkende Kraft KraftWird an eine Elektrode ein Potential angelegt, so wirkt auf die Ionen in dem Elektrolyten eine Kraft. Die Ursache ist ein elektrisches Feld in Elektrodennähe, das im weiteren als das ursprüngliche oder natürliche elektrische Feld bezeichnet werden soll. Ein isoliertes elektrisches Feld, das diesem ursprünglichen Feld an der Elektrode entgegen gerichtet ist, wird die Wanderung der Ionen verlangsamen, da sich der Gradient der elektrischen Feldstärke verringert. Die Verminderung dieser Feldstärke hat eine Verringerung des Stroms zur Folge, da die Kraft, die auf die Ionen wirkt, abnimmt und damit die Ionenwanderung verlangsamt. Da es sich aber um ein isoliertes elektrisches Feld handelt, bleibt das Elektrodenpotential gegen den Elektrolyten davon unberührt. Das bedeutet Oxidationen bzw. Reduktionen werden weiter bei einem substanzspezifischen Elektrodenpotential stattfinden. Das Elektrodenpotential bestimmt unabhängig vom Kräfteeinfluß, das auf die Ionen wirkt, welche Reaktionspartner an der Elektrode oxidiert bzw. reduziert werden.Die KonsequenzIn einem Gedankenexperiment soll nun der Strom an der Elektrode durch ein überlagertes elektrisches Feld konstant gehalten werden und die Migration der Ionen beeinflussen. Die Kraft, respektive die Feldstärke, die dazu nötig ist, muß sich dann in Abhängigkeit von der Anzahl der zur Verfügung stehenden Ionen ändern. Es wird zunächst einmal von einem Elektrodenpotential ausgegangen, bei dem einer von drei möglichen Reaktionspartnern, die oxidiert werden können, sein Elektron an der Elektrodenoberfläche abgibt (Abb.1). Um die Migration der Ionen und somit den Strom konstant zu halten, ist eine bestimmte Feldstärke notwendig. Wird das Potential erhöht und damit ein Redoxbereich erreicht, bei dem ein weiterer der Reaktionspartner oxidiert wird (Abb.2), entsteht ein zweites Ion. Diese, neu zum System hinzugekommene Ionenart trägt zum Strom bei. Der Strom wird größer. Um wieder einen voreingestellten Sollwert für den Strom zu erreichen, muß die Migration der Ionen gebremst werden. Dazu ist eine höhere Feldstärke nötig, die sich auch bei weiterer Anhebung des Elektrodenpotentials wieder auf einen stationären Wert einstellen wird. Erst wenn das Elektrodenpotential soweit erhöht wurde, daß der letzte Reaktionspartner oxidiert wird (Abb.3), ändert sich abermals die Feldstärke, um den Strom an der Elektrode konstant zu halten. Es ist also entsprechend dem vorgelegten Elektrodenpotential eine stufenförmige Regelkurve zu erwarten, da sich die Reaktionspartner durch ihr definiertes Redoxpotential unmittelbar bemerkbar machen. Dabei steht das jeweilige Elektrodenpotential einer Stufe für den entsprechenden Reaktionspartner und die Stufenhöhe kann dabei für die quantitative Aussage von Nutzen sein.Die notwendigen elektrischen FelderDie Feldstärken, die sich aus diesen Überlegungen ergeben würden, müßten bei Potentialdifferenzen von ca. einem Volt und einem angenommenen Abstand von einem Nanometer eine Größenordung von einem Gigavolt pro Meter erreichen [3]. Gute Isolatoren weisen jedoch eine Durchschlagsspannung von einigen hundert Megavolt pro Meter auf. Zudem ist es erforderlich, daß die Feldlinien des natürlichen Feldes und die des induzierten Feldes möglichst parallel verlaufen um Inhomogenitäten zu vermeiden. Aus diesem Grund wurde mit sehr feinen Nadelspitzen aus Edelstahl gearbeitet, die exakt unter einer Mikrodiskelektrode positioniert wurden. Die Abbildung 4 zeigt unter der Annahme, daß sich noch keine Doppelschicht auf der Elektrodenoberfläche ausgebildet hat, die Feldlinien an der Mikrodiskelektrode. Die Mitte der Arbeitselektrode weist Feldlinien auf, die annähernd parallel verlaufen. Am Rand der Elektrode richten sich die Feldlinien radial aus. Die Feldlinienausrichtung kann somit sowohl für das natürliche Feld (a) als auch für das induzierte elektrische Feld (b) an diesen Arbeitselektroden als parallel angenommen werden. So wird vorausgesetzt, daß sich durch diese Anordnung nicht die Ausrichtung der elektrischen Feldlinien, sondern nur ihr Gradient ändert. Modell- und Simulationsrechnungen zum Verhalten der Feldlinien für diese Anordnung werden zur Zeit durchgeführt und sollen die Annahmen zum Feldlinienverlauf bestätigen. Der Strom, der über die Arbeitselektrode fließen sollte, wurde mit dem oben dargestellten MSR-System vorgegeben. Dazu baute die Meßvorrichtung (Abb.5) über eine Regelstrecke ein kompensierendes elektrisches Feld auf, um den Stromfluß auf einem voreingestellten Niveau zu halten. Das Regelsystem besteht aus zwei invertierenden Integrierern [5,6], wobei die Regelstrecke über die RC-Glieder gesteuert werden kann.Die Ergebnisse – die EinflüsseMit diesem Meßsystem wird ein Gleichgewichtszustand erreicht, der so stabil ist, daß ein Redoxbereich an der Platinelektrode von –2000 mV bis 2000 mV gescannt werden kann, ohne daß es zu einer limitierenden Wasserstoff- bzw. Sauerstoffentwicklung kommt (Abbildung 6). Zudem zeigt sich im Potentialbereich von 300 bis 900 mV eine charakteristische Regelkurve (Abb. 7). Diese Regelkurve weist Stufen auf. Redoxpotentialbereiche mit beinah gleichbleibendem elektrischen Feld könnten bedeuten, daß die Anzahl der Reaktionssysteme konstant geblieben ist. An der Stelle eines sprunghaften Anstiegs der Feldstärke ist ein Redoxpotential erreicht worden, bei dem eine weitere Substanz im Elektrolyten oxidiert oder nicht mehr reduziert wird. Diese ändert den Stromfluß an der Arbeitselektrode. Ihr Beitrag zum Strom wird von dem Meßsystem erfaßt und von dem E-Feld über die Regelstrecke kompensiert. Obwohl ein Reaktionspartner bei dem Redoxpotential von z.B. 870 mV hinzugekommen ist, wird der Strom von dem elektrischen Feld weiter auf zehn Picoampere gehalten. Die Folge des hinzugekommenen Reaktionspartners ist also eine Änderung der Feldstärke. Ein weiterer Sachverhalt für diesen Gleichgewichtszustand ist bemerkenswert. Die Scangeschwindigkeit hat keinen Einfluß auf den Strom. Das Verhalten der Feldstärke wird unabhängig von der Scangeschwindigkeit beibehalten. Das läßt die Schlußfolgerung zu, daß keine Ladeströme mehr auftreten, weil die äußere Helmholtz-Schicht eliminiert ist. Die Regelkurve bleibt in ihrer Charakteristik erhalten und ändert sich in dem signifikanten Bereich nur minimal, was auf die Voreinstellungen der Regelstrecke zurückgeführt werden kann.FazitDie Entdeckung, den Strom an einer Mikrodiskelektrode mit einem elektrischen Feld zu manipulieren, eröffnet neue Möglichkeiten, die elektrochemischen Vorgänge an Elektroden zu untersuchen. Die Elektrodenreaktionen für anodische und kathodische Ströme können separat beleuchtet werden. Denkbar ist auch, Elektroden gezielt mit Ionen zu beladen, um sie anschließend zu oxidieren bzw. zu reduzieren. Auch diese besondere Art der Elektrodenbelegung schafft neue Wege in der elektrochemischen Grundlagenforschung.AusblickWesentlich an dieser neuen Methode ist die Tatsache, daß mit sehr kleinen Elektroden gearbeitet werden kann. Eine Realisierung des gesamten Meßsystems in Halbleitertechnologie ist damit möglich. Für die Schaltung, die für die Messung der kleinen Ströme im Pico- und Femtoamperebereich und die vollständige Steuerung des elektrischen Feldes erforderlich ist, werden zur Zeit lediglich vier Operationsverstärker benötigt. Dies ist im Hinblick auf die Entwicklung eines robusten analytischen Meßverfahrens, speziell im Bereich der Sensortechnologie für die Online-Prozeßüberwachnung, ein großer Vorteil, da somit kleinste Probevolumina schnell vermessen werden können. Für diesen Sensor wird aufgrund seiner Baugröße zudem nur sehr wenig Edelmetall benötigt.Literatur* J. Chopart, A. Olivier, A New Experimental Device for Convective Mass-Transport Analysis by Electrokinetic-Hydrodynamic Effect, Electrochemical and Solid-State Letters 1/3 (1998) 139-141. * W. Schmickler, Grundlagen der Elektrochemie, Vieweg Lehrbuch Physikalische Chemie, 1996. * P. Atkins, Physikalische Chemie, Verlag Chemie, Weinheim 1987, 811-822. * P. Schönweitz, Untersuchungen zu Meßverfahren in wässerigen Medien, Dissertation TU-München, (1997) 40-44. * H.Wupper,Professionelle Schaltungstechnik mit Operationsverstärkern, Franzis-Verlag, (1994), 41-45, 142-147. * H.Wupper, U.Niemeyer, Elektronische Schaltungen 2, Springer-Verlag Berlin, (1996), 74-78.
Abbildung 1 Bei einem vorgegebenen Elektrodenpotential wird einer von drei möglichen Reaktionspartnern oxidiert. Um den Strom konstant zu halten, ist eine definierte und dem ursprünglichen Feld entgegengerichtete Feldstärke notwendig. Abbildung 2 Bei einer Erhöhung des Elektrodenpotentials, kommt es zur Oxidation des zweiten von drei möglichen Reaktionspartnern. Abbildung 3 Bei weiterer Erhöhung des Elektrodenpotentials, kommt es zur Oxidation des letzten der drei möglichen Reaktionspartnern. Die entgegengerichtete Feldstärke erhöht sich wieder, um den Strom konstant zu halten. Abbildung 4 Die Ausrichtung der elektrischen Feldlinien im Elektrolyten (a) und die des von einer Nadelspitze induzierten Feldes (b). Abbildung 5 Schematische Darstellung der Versuchsanordnung Abbildung 6 Bei der Elektrode kann ein Potential von –2000 bis +2000 mV vorgelegt werden. Dabei bleibt das neue Gleichgewicht erhalten. (Die rote Linie beschreibt die I/U-Kurve; die blaue Linie beschreibt die E/U-Kurve) Abbildung 7 Regelkurve des elektrischen Feldes zur Aufrechterhaltung eines Stromes von 10 pA an einer Mikrodiskelektrode in 0,1 M Schwefelsäure |